2022年5月6日

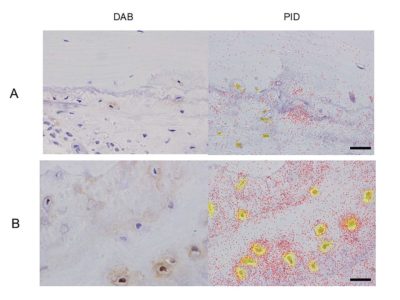
自身がオーストラリアのアデレード大学留学中に、常染色体顕性大理石骨病を疑う症例が同大学の整形外科におられ、遺伝子解析を担当しました。しかし同疾患の原因遺伝子として知られているCLCN7のエキソン領域には変異を認めず、その当時の技術ではCLCN7 mRNAの発現量が健常人と比較して低下していることを確認するのが精いっぱいでした。
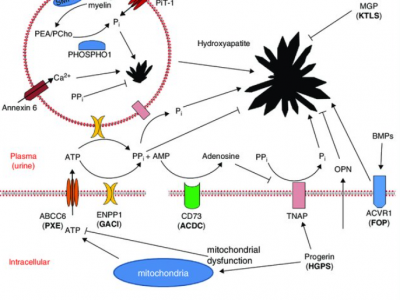
その後徐々にwhole exome sequence や whole genome sequenceの実施コストが低下し利用しやすくなったため、アデレード大学の留学先の先生方にご協力頂き改めて患者さんから同意を取得し、CLCN7mRNA発現量低下の原因を突き止めるために whole genome sequence を実施いたしました。そうすると、CLCN7のdeep intron領域に6塩基配列の反復延長が両アレルで認められ、これによってCLCN7の発現量が低下していると予測することができました。
神経疾患では同様の両アレルにおけるdeep intron領域反復配列の延長によって、mRNA発現に抑制がかかり発症する疾患が既に知られていました。神経疾患以外でも今回のように、これまでの whole exome sequence では原因不明であった疾患において、deep intronでの両アレルの反復配列延長がmRNA発現を抑制することで、本来の常染色体潜性遺伝形式で予想される疾患の重症度よりも、常染色体顕性遺伝形式で認められるような中等度の症状を呈するケースがあることが分かりました。今後、様々な診療科の疾患においてこのようにdeep intronやその他のnon-coding lesionにおける変異が疾患の原因として同定されていくのではないかと予想します。
本論文は欧州骨代謝学会の機関紙であるCalcified Tissue Internationalにアクセプトされました。今回改めて研究にご協力頂いた患者さんをはじめ、アデレード大学整形外科学・外傷学の先生方、 whole genome sequence の結果を解析しCLCN7 deep intronの繰り返し配列の延長を同定してくれた 特任臨床医の加藤創生先生に謝意を表します。